Terapia CAR-T Cell: como vem sendo aplicada no Brasil?

Última atualização em 7 de julho de 2023
Há algumas diferenças entre os tratamentos que foram aprovados, o que está sendo comercializado e a situação no Sistema Único de Saúde
Há cerca de um ano, a Agência Nacional de Vigilância Sanitária (Anvisa) aprovou a entrada da primeira terapia CAR-T Cell no Brasil. Depois dela, dois outros tratamentos dessa linha foram aprovados, mas somente a partir de novembro que a comercialização foi iniciada. Além disso, desde essa primeira aprovação, hospitais brasileiros desenvolveram e estão participando de estudos para analisar novos procedimentos e criar terapias totalmente nacionais.
Em fevereiro de 2022 o Kymriah® (tisagenlecleucel), da empresa Novartis Biociência, chegou ao nosso país. Ele foi aprovado para pacientes de leucemia linfoide aguda (LLA) B refratária ou a partir da segunda recidiva com até 25 anos e pacientes adultos com linfoma difuso de grandes células B.
Em abril, foi a vez do Carvykti® (ciltacabtageno autoleucel), da empresa Janssen-Cilag Farmacêutica, ser aprovado para pacientes de mieloma múltiplo (MM) que já realizaram, pelo menos, três terapias anteriores.
Alguns meses depois, em outubro, a terceira terapia, o Yescarta® (axicabtagene ciloleucel), da Kite, recebeu aval da Anvisa. Ele é recomendado para pacientes adultos com linfoma de grandes células B recidivado ou refratário.
Porém, apesar de todos esses procedimentos já estarem aprovados, somente o Kymriah® foi precificado, ou seja, foi definido o quanto ele vai custar, e está sendo comercializado – segundo a Câmara de Regulação do Mercado de Medicamentos (CEMED), ele poderá custar até R$ 2,1 milhões por paciente. O Yescarta® está em processo de ser precificado e alguns centros de tratamento brasileiros estão realizando o estudo CARTITUDE-5, com o Carvykti®.
Como está a terapia CAR-T Cell no Brasil?
-
Para quem usa o sistema privado ou tem plano de saúde
Como falado anteriormente, até o momento, o Kymriah® é o único a ter seu preço definido e, por isso, é o único que está sendo realizado de forma comercial. Para poder aplicar esse tipo de terapia, os hospitais precisam ter uma série de certificações e possuir instalações apropriadas para cuidar do paciente. Um dos centros de tratamento que está trabalhando com essa terapia é o A.C Camargo Cancer Center, em São Paulo.
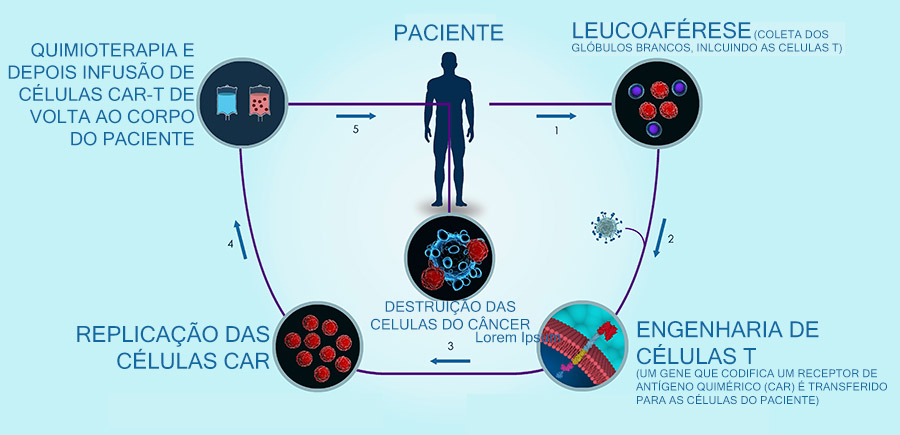
O Dr. Jayr Schmidt Filho, líder do Centro de Referência de Neoplasias Hematológicas do A.C.Camargo Cancer Center, conta que até fevereiro de 2023, foram realizadas duas infusões da terapia com o produto da Novartis e que, após a precificação do Yescarta®, eles passarão a também oferecer esse procedimento.
Em janeiro deste ano, pela primeira vez, um plano de saúde cobriu a terapia CAR-T. O procedimento foi realizado no Complexo Hospitalar de Niterói (CHN) e a Drª. Jordana Ramires Aragão, hematologista especialista em transplante de medula óssea e terapia celular, relata que o paciente beneficiado era um homem de 74 anos com linfoma difuso de grandes células B que já tinha passado por três diferentes tipos de tratamento e não teve sucesso.
“Nesse caso, inicialmente, o paciente recebeu alguns ciclos de quimioterapia padrão, mas não obteve resposta satisfatória. Foi submetido a uma segunda linha de tratamento, com uma quimioterapia diferente da primeira, também sem sucesso. Após essas duas linhas de terapia sistêmica mal-sucedidas, ele ainda foi submetido à radioterapia local, mas o linfoma persistiu ativo. Por isso, foi considerado refratário a todas as tentativas de tratamento realizadas”, a Drª. Jordana descreve.
Como foi o processo com o plano de saúde

“A primeira etapa de todas foi o envio do relatório ao convênio de saúde do paciente. Entre a solicitação do tratamento e a autorização para realização da aférese (procedimento de coleta dos linfócitos T) decorreram-se 26 dias. O tempo entre a coleta dos linfócitos e o envio para manufatura, no laboratório da empresa Novartis, nos EUA, foi de 7 dias. O tempo entre o envio das células para os EUA e o retorno do medicamento manufaturado ao Brasil foi de 47 dias. Seis dias após a chegada do medicamento à instituição, as células CAR-T foram infundidas no paciente”, a Drª. Jordana detalha.
Glossário de Oncologia: entenda o que cada termo significa!
Já se perguntou o que “sobrevida” quer dizer? Te explicamos o sentido dessa e várias outras palavras
-
Para quem usa o Sistema Único de Saúde (SUS)
O CAR-T ainda não foi incorporado ao SUS, devido, principalmente, ao alto custo da terapia. Mas há algumas iniciativas públicas para desenvolver um tratamento que seja menos custoso e possa ser disponibilizado para esses pacientes.

Em junho do ano passado, foi divulgado que seriam entregues duas “fábricas de células” no estado de São Paulo para produzir em larga escala as células CAR-T. Uma das fábricas ficaria na capital do estado, no Instituto Butantan, e a outra em Ribeirão Preto, na Universidade de Medicina da USP.
De acordo com a Revista Exame, entre os dias 14 e 20 de junho as duas fábricas foram entregues: uma no Núcleo de Terapia Celular (Nucel) e a outra no Núcleo de Terapia Avançada (Nutera). O objetivo é que, com a produção nacional, seja possível reduzir o custo para que ela tenha um valor que deve variar de 3% a 5% menos que o preço da terapia importada.
A previsão é que essas fábricas consigam atender até 300 pacientes por ano.
Além disso, o Instituto Butantan, também em parceria com a Faculdade de Medicina de São Paulo e o Hemocentro de Ribeirão Preto, começou a testar no primeiro semestre deste ano um CAR-T para linfoma não-Hodgkin de células B. O teste engloba por volta de 30 pacientes com idades entre 18 e 70 anos, tem como foco pacientes que tiveram uma recidiva após o tratamento com terapias convencionais e sua duração é de um ano.
Segundo o jornal O Globo, esse mecanismo já foi utilizado por brasileiros, mas por meio de ‘testes compassivos’, quando as estratégias terapêuticas já foram esgotadas.
A ideia é que, com essa pesquisa, o CAR-T Cell possa ser oferecido no SUS.
-
Estudos com a Terapia CAR-T
Atualmente, há dois principais estudos em andamento no Brasil: o CARTITUDE-5 e um estudo acadêmico, criado pelo Hospital Israelita Albert Einstein.
O CARTITUDE-5 é um estudo multicêntrico e multinacional, isto é, que acontece em diversos centros de vários países, e é realizado com o Carvykti® para pacientes de mieloma múltiplo recém-diagnosticados. O objetivo da pesquisa é analisar qual tratamento tem melhor resposta: quimioterapia de indução (bortezomibe, lenalidomida e dexametasona) e com uma única aplicação da CAR-T Cell ou quimioterapia de indução seguida de manutenção (lenalidomida e dexametasona).
“Nosso interesse é saber se pacientes que não são elegíveis a transplante autólogo se beneficiariam do CAR-T mais precocemente”, esclarece o Dr. Nelson Hamerschlak, hematologista e coordenador do Programa de Hematologia e Transplantes de Medula Óssea do Einstein.
O Dr. Jayr Schmidt comenta que o estudo está em aberto, então eles ainda estão incluindo pacientes que fizeram somente uma linha de tratamento quimioterápico.
“As pessoas podem ser acomodadas no braço CAR-T ou no braço não CAR-T. Até agora, dois pacientes já foram para o braço CAR-T e já tiveram suas infusões realizadas. A primeira infusão ocorreu no fim de novembro do ano passado, a gente teve o segundo paciente que recebeu a infusão em janeiro deste ano”, ele complementa.
Além do CARTITUDE-5, o Hospital Israelita Albert Einstein está desenvolvendo um estudo acadêmico próprio.
“O outro estudo que iniciamos é em leucemia linfocítica aguda e linfomas B agressivos de grandes células que já fizeram mais de duas linhas de tratamento. Trata-se do primeiro estudo acadêmico aprovado pela Anvisa no Brasil, desenvolvido no próprio Einstein com a plataforma Prodigy”, o Dr. Hamerschlak diz.
Ele ainda fala que a primeira paciente já foi incluída e o hospital pretende incluir mais nove (totalizando 10 pessoas) até o final do ano. Quem estiver interessado em entrar nesse estudo deve encaminhar seu relatório médico para o e-mail [email protected].
O que esperar das primeiras terapias CAR-T Cell aprovadas no país?
De grande promessa à realidade para os pacientes onco-hematológicos brasileiros. Entenda como os tratamentos funcionam e quando podem ser indicados
Curiosidades sobre a terapia CAR-T Cell
No caso tratado pela Drª. Jordana, por exemplo, o paciente tinha 74 anos e isso não foi um problema.
“Apesar da idade avançada ser considerada um critério de exclusão para algumas terapias oncológicas consideradas agressivas, como o transplante de medula óssea, o tratamento com células CAR-T, para a indicação de linfoma difuso de grandes células B, não exige esta restrição. O medicamento é indicado para pacientes adultos sem limite de idade máxima”, a médica pontua.
Ela explica que, na maioria das vezes, a condição geral da saúde do paciente, seu nível de função cognitiva e de condicionamento físico são mais relevantes que a idade da pessoa.
“Além disso, dados dos estudos clínicos mostraram que os pacientes mais velhos (acima de 65 anos) se sairiam tão bem quanto os pacientes mais jovens, em termos de eficácia e tolerância ao tratamento com células T geneticamente modificadas.”
Atualmente, cerca de dois meses após a infusão, o paciente encontra-se bem de saúde, com sinais de melhora do linfoma e redução significativamente visível do tamanho da massa linfomatosa que apresentava previamente.
A Drª. Jordana pontua que “os pré-requisitos para a estruturação de um centro especializado em terapia celular avançada, apto para tratamento com células CAR-T, são muito semelhantes às exigências para o credenciamento e habilitação de um serviço de transplante de medula óssea alogênico no Brasil.”
O Dr. Jayr Schmidt declara que, em 2019, o hospital A.C. Camargo iniciou o processo de adequar as estruturas e a equipe.
“A gente investiu muito na questão de adequação de alguns itens de infraestrutura, especialmente relacionados à parte de hemoterapia e armazenamento das células. Também fizemos adequações na própria unidade de internação onde os pacientes ficam. Mas o principal foi o treinamento de equipe multiprofissional, de todas as que estivessem envolvidas com o cuidado do paciente, como infectologista, neurologista, intensivista, enfermagem, farmácia e fisio. Foram muitas rodadas de treinamento com essas equipes.”
A Drª. Jordana Ramires Aragão ainda complementa que as entidades reguladoras exigem a disponibilidade de um medicamento utilizado para o tratamento imediato de um dos efeitos colaterais graves, que é a síndrome de liberação de citocinas. Além disso, o requisito adicional mais importante é que toda a equipe multiprofissional envolvida no cuidado do paciente seja devidamente treinada e capacitada para reconhecer e tratar os efeitos colaterais potencialmente graves desta terapia.




Qual o plano mencionado que aprovou no A.C Camargo? Minha irma tem o linfoma e queria saber de ante mão, se a GNDI/Notre dame tem acesso
Olá, Gabriela, como vai?
O procedimento que foi aprovado pelo convênio foi no Complexo Hospitalar de Niterói (CHN)! Nós não temos essa informação de qual foi o plano, mas a senhora pode tentar ligar nesse hospital e ver se eles podem te passar essa informação. O contato deles é (21) 2729-1000.
A senhora e/ou sua irmã já conhecem o trabalho da Abrale? Nós somos uma ONG que auxilia pacientes com cânceres hematológicos, como o linfoma, por meio de diversos serviços gratuitos! Caso tenham interesse, podem entrar em contato com o nosso Apoio ao Paciente, para que a gente possa conversar mais, contar sobre nosso trabalho e apoiarmos vocês como precisarem. Basta enviar uma mensagem para o nosso WhatsApp 11 3149-5190 (ou clique no link) para que possamos fazer o seu cadastro! Só pedimos para que, no primeiro momento, não envie áudio para que nosso sistema possa entender a sua demanda e encaminhar para o departamento correto.?
Você também pode entrar em contato conosco por estes canais:
– Telefone: 11 3149-5190 ou 0800-773-9973
– E-mail: [email protected]
– Site: https://www.abrale.org.br/fale-conosco/
Abraços!
Ola, Tenho minha mãe, Irma Dolorice Manhi Panisso ( linfoma não hodgkin de grande celulas B, paciente em tratamento desde 2019, fez uma seção de 6 quimioterapia, teve recidiva, fez radioterapia, passando alguns meses, voltou a fazer 8 seções de químico, voltou a ter nódulos na perna que foi removido no inicio de 2023, no seu ultimo pet apareceram mais 2 linfonodos aumentados, como proceder para fazer parte dos estudos??
Meu Nome é Antonio Ap Panisso Cel 11 96452-6182
grato.
Olá, Antônio, como vai?
O primeiro passo é conversar com o médico que acompanha a sua mãe para que ele explique se esse tratamento pode ser indicado para o caso dela. Se ele disser que sim, o próprio médico precisa enviar um e-mail para [email protected], contendo o relatório médico médico dela e uma justificativa do porquê participar do estudo seria benéfico para ela.
O senhor já conhece o trabalho da Abrale?
Nós somos uma ONG que auxilia pacientes e familiares de pacientes com algumas doenças hematológicas, como o linfoma, por meio de diversos serviços gratuitos! Caso tenha interesse, pode entrar em contato com o nosso Apoio ao Paciente, para que a gente possa conversar mais, te contar sobre nosso trabalho e apoiarmos você como precisar. Basta enviar uma mensagem para o nosso WhatsApp 11 3149-5190 (ou clique no link) para que possamos fazer o seu cadastro! Só pedimos para que, no primeiro momento, não envie áudio para que nosso sistema possa entender a sua demanda e encaminhar para o departamento correto.?
Você também pode entrar em contato conosco por estes canais:
– Telefone: 11 3149-5190 ou 0800-773-9973
– E-mail: [email protected]
– Site: https://www.abrale.org.br/fale-conosco/
Ficamos no seu aguardo ?
Abraços!
BOM DIA
ME CHAMO MARTHA,TENHO UM FILHA QUE HÁ05 ANOS DESCOBERTA DE CÂNCER DE MAMA,T/TO COM QUIMIO E CIRURGIA,AGORA COM RECIDIVA LINFÁTICO,GOSTARIA DE SABER SE PODE SER TRATADO COM CART T.
OBRIGADA.
Olá, Martha, como vai?
Infelizmente, ainda não há tratamentos com CAR-T para o câncer de mama, por enquanto, ele só está disponível para alguns tipos de leucemia, linfoma e mieloma múltiplo ☹️
Mas, pode ser que exista algum estudo aberto com alguma outra terapia inovadora para o caso da sua filha. Conversem com o médico dela para que ele possa explicar se há algum estudo aberto que ela se encaixe.
Abraços!
Olá bom dia
Eu gostaria do referências de vocês, por gentileza. Estou construindo um trabalho e seria maravilhoso se tivesse essas informações.
Olá, Claudio, como vai?
Pode nos citar sem problema algum, ficamos honrados!
Este conteúdo foi escrito pela jornalista Natália Mancini (prazer, eu 😄), foi publicado em 30 de março de 2023
e a última atualização aconteceu em 7 de julho de 2023.
Abraços!